Как подготовиться к егэ по химии в 2021: эффективные методики
Содержание:
- 10 класс
- Изменения в ЕГЭ по химии 2022
- sp-Гибридизация
- Изомерия
- «Лектариум»
- ЕГЭbox
- Углеводороды
- Как запомнить термины по химии
- PĀRTA
- sp3-Гибридизация
- Советы для подготовки к ЕГЭ по химии
- Составьте план
- Выберите наставника
- Определите ресурсы для подготовки к ЕГЭ
- Изучите спецификацию КИМ по предмету
- Внимательно читайте задания тестовой части
- Изучите критерии оценивания заданий части 2
- Не читайте узкоспециализированную литературу
- Научитесь работать с непрограммируемым калькулятором
- Проверяйте свои знания
- Простые и сложные вещества. Валентность
- Теория к заданию 32 из ЕГЭ по химии
10 класс
Что нужно знать и уметь к промежуточной аттестации по химии
- Владеть понятиями органической и неорганической химии.
- Знать основные положения теории химического строения. Понятия: изомер, гомолог, гомологический ряд, пространственное строение. Классификацию и виды изомерии. Уметь составлять структурные формулы изомеров. Уметь строить гомологические ряды основных классов органических соединений.
- Знать важнейшие физические и химические свойства основных представителей изученных классов органических веществ.
- Владеть классификацией углеводов по различным признакам.
- Знать характеристики важнейших классов кислородсодержащих веществ.
Способы подготовки к аттестации в 10 классе
Химия — сложный предмет, и иногда учебников мало, чтобы её понять. В этом случае поможет книга М.М. Левицкого «Увлекательная химия. Просто о сложном, забавно о серьёзном». Наука в ней плотно связана с историческими очерками, так что вы не только повторите школьную программу перед промежуточной аттестацией, но и углубите свои знания. В конце книги автор предлагает посмеяться над химическими шутками.
С интересом подготовиться к промежуточной аттестации по химии в 10 классе поможет игра для iOS Chemistry Lab. В ней вы сможете самостоятельно провести любой химический опыт всего за несколько минут. Игровая лаборатория содержит оборудование, неорганические соли, гидроксиды, кислоты, простые вещества и оксиды. Вещества имеют цвет и агрегатное состояние, как в действительности. Результат реакции красочен и реалистичен, а ещё игра высвечивает уравнение, которое объясняет, что произошло.
Изменения в ЕГЭ по химии 2022
Задание № 5 в вариантах прошлых лет предполагало установление соответствия между формулами или названиями веществ и классами неорганических соединений. Теперь перед выпускниками появится таблица из девяти ячеек с формулами веществ, среди которых нужно выбрать три согласно условию задания.
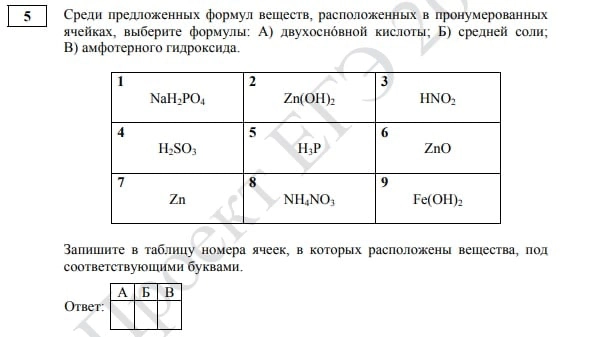
Задание № 5, ЕГЭ по химии 2022
Ребята, которые не разбираются в химических свойствах простых веществ и оксидов, могут ненадолго выдохнуть, ведь задание на эти классы веществ (ранее № 6) исчезло из КИМа 2022 года. Но не спешите радоваться слишком сильно. Эти темы все равно придется освоить, ведь это может встретиться как в первой, так и во второй части ЕГЭ.
В задании на поиск изомеров, гомологов и других особенностей строения органических молекул теперь вместо выбора двух ответов выпускникам предстоит выбрать все правильные ответы. Практика показывает, что чаще верными являются 2, 3 или 4 ответа.
Бывшие задания 13 (свойства и получение углеводородов) и 14 (свойства и получение кислородсодержащих веществ) теперь объединены в одно задание с выбором двух правильных ответов.
Небольшое изменение коснулось задания на электролиз. Одно стало несколько проще. Теперь нужно установить продукты электролиза для трех соединений, а не четырех. Вместе с тем уменьшилась и «стоимость» этого номера: один первичных балл вместо двух.
Задание на гидролиз изменилось кардинально. Выпускникам предстоит не только установить тип среды в растворе предложенных веществ, но и расположить их в определенном порядке изменения рН раствора. Но не спешите паниковать, в КИМе появились подсказки именно для этого номера: вам предлагается шкала изменения рН и типов среды растворов.

Справочные материалы к заданию № 21 на гидролиз, ЕГЭ по химии 2022
И последнее изменение — это появление нового задания на концентрацию № 23. Оно представляет собой уравнение химической реакции, а также таблицу с концентрациями каждого участника. На первый взгляд, это задание требует принципиально новой теории и формул. Но поверьте, немного практики и навык владения калькулятором помогут получить за этот номер максимальные баллы.
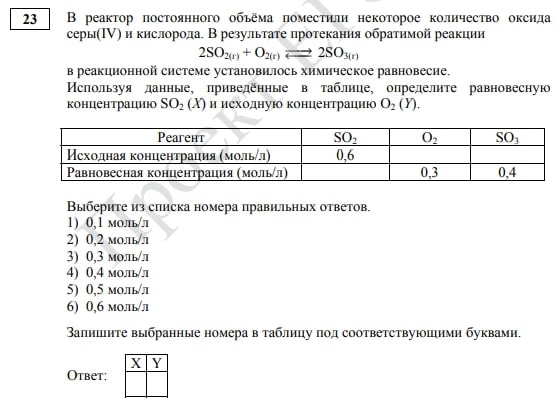
Задание № 23, ЕГЭ по химии 2022
Хотите сдать ЕГЭ на высокие баллы, но не знаете, как приступить к подготовке? Вам поможет учебный центр MAXIMUM! Наши преподаватели знают, как подготовить ученика на 80+ баллов, ведь они сами отлично сдали этот экзамен. Читайте подробнее про наши курсы и выбирайте подходящий!
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:

| Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180одруг к другу, что соответствует линейному строению. |

Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
| Например, молекула ацетилена имеет линейное строение. |
Изомерия
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:

При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
«Лектариум»

Интенсивная подготовка к ЕГЭ по химии.
На базовом тарифе включено:
- 12 онлайн-занятий (записи доступны в личном кабинете до конца года)
- 12 домашних работ после каждого занятия с ответами
3 пробника для контроля прогресса и успеваемости с ответами - Скрипты, конспекты каждого урока
- Без поддержки куратора.
Также есть тарифы: с поддержкой и обратной связью от куратора по ДЗ, с помощью по школьной программе и поддержкой психолога.
Программа курса по Химии на учебный год:
- Сентябрь: Общая химия
- Октябрь: Неорганика. Введение
- Ноябрь: Неорганика. Продолжение
- Декабрь: Органика. Введение
- Январь: Органика. Продолжение
- Февраль: Практический курс + наложение сложной теории. Неорганика
- Март: Практический курс + наложение сложной теории. Органика
- Апрель: Расчетные задачи
- Май: Вторая часть экзамена
ЕГЭbox

Сайт — egebox.ru/courses/11/chem/ Длительность обучения — индивидуально. Стоимость обучения — 1 013 рублей в месяц.
Портал ЕГЭbox гарантирует поступление своих учеников на бюджетные места, потому что подготовку к ЕГЭ ведут только опытные педагоги по авторским методикам, проверенным временем. Выпускники ЕГЭbox без проблем поступают в выбранные ВУЗы с результатами ЕГЭ от 85 баллов.
Особенности обучения в ЕГЭБокс:
- входное тестирование;
- распределение учащихся в группы по 25 человек в соответствии с уровнем подготовки;
- отдельные программы для каждой группы обучающихся;
- домашние задания после каждого урока с обратной связью от преподавателя;
- поддержка куратора 24/7;
- психологическая подготовка к экзамену;
- пробные ЕГЭ;
- регулярные отчеты для родителей и контроль за прогрессом учеников.
Углеводороды
| Углеводороды– это вещества, состав которых отражается формулой СхНу, то есть в их составе только атомы углерода и водорода. |
В зависимости от типа связей между атомами С, они делятся на предельные или насыщенные (все связи одинарные) и непредельные (ненасыщенные) — в молекуле присутствуют двойные и тройные связи.
Кроме того, углеводороды делятся на циклические (углеродная цепь образует кольцо) и ациклические или алифатические (углеродная цепь не замкнута в кольцо).
| Углеводороды | |||||
| Предельные (содержат только одинарные связи) | Непредельные (содержат двойные или тройные связи между атомами углерода) | ||||
| Алканы | Циклоалканы | Алкены | Алкадиены | Алкины | Ароматические углеводороды |
| Углеводороды с открытой (незамкнутой) углеродной цепью | Атомы углерода соединены в замкнутый цикл | Одна двойная связь | Две двойные связи | Одна тройная связь | Циклические углеводороды с тремя двойными связями (бензольное кольцо) |
| CnH2n+2 | CnH2n | CnH2n | CnH2n-2 | CnH2n-2 | CnH2n-6 |
|
Этан
CH3-CH3 |
Циклобутан |
Этилен
CH2=CH2 |
Дивинил
CH2=CН-СН=СH2 |
Ацетилен
СН≡СН |
Бензол |
| Ациклические углеводороды | |
| С неразветвленной цепью | С разветвленной углеродной цепью |
|
н-Бутан
CH3-CH2-CH2-CH3 |
Изобутан |
Как запомнить термины по химии
Изучая такую науку, как химия, нужно потратить достаточно времени перед экзаменом ЕГЭ, чтобы убедиться, что вы можете правильно пользоваться терминологией, которую учили в течении всего курса. Главная проблема в том, что большинство терминов достаточно трудно запомнить.
Однако, применив немного изобретательности, можно быстрее понять язык химии, биологии или физики. Всегда можно найти связь, если её искать.
Создать запоминающиеся образы для любых технических терминов очень легко. Потратьте немного времени во всем повторении материала, чтобы создать собственный список запоминающихся образов для главных терминов, которые необходимы на экзамене.
Несколько примеров:
Элементы
Элементы содержат только один вид атомов. Их нельзя расщепить на более простые вещества.
Сложные соединения
Это сложные вещества, состоящие из атомов двух или более различных химических элементов, объединенных хим. связью. Могут расщепляться на более простые. Подумайте о загоне для животных, в котором живут несколько видов.
Кислоты
Кислоты – это вещества, которые: 1) Превращают синюю лакмусовую бумажку в красную. Представьте себе милиционера в синей форме, краснеющего от злости. 2) Кислые на вкус: представьте себе вкус уксуса. 3) При взаимодействии с металлами образуют соли: представьте себе членов тяжелой металл-группы, играющих на «кислой» домашней вечеринке и превращающиеся в столбы из соли. 4) Нейтрализуют основания (базы): бас-гитара нейтрализована.
Сплавы
Сплавами называют любые однородные системы, образованные сплавлением металлов, неметаллов, оксидов, органические в-тв и т.д., и закрепления полученной смеси. Латунь, например, это сплав из меди и цинка. Подумайте о том, как несколько человек сплавляются на плотах.
Растворение
Это происходит, когда вещество впитывает влагу или воду и растворяется, образуя раствор. Чтобы запомнить это, представьте, как ваш любимый шербет, который слишком долго простоял в шкафу на кухне, превратился в жидкую массу.
Эфлоресценция
Это происходит, когда кристаллическое вещество превращается в порошок под воздействием воздуха или когда соль выходит на поверхность вещества и кристаллизируется. Представьте себе флуоресцентный поток, в котором содержаться растворенные кристаллы, высыхающие на воздухе и превращающиеся в порошок.
Алкоголь
Алкоголь состоит из углерода, водорода и кислорода. Это можно запомнить, если подумать об алкоголе следующее: «Купил, выпил, упал», или алкоголь, содержащийся в напитках, произведён путём брожения сахара и дрожжей.
Ионы
Ионы – это частицы, которые переносят электрический заряд. Они могут (+) заряженные и (-) заряженные. Подумайте о положительных и отрицательных шпионах.
Анионы
Это (-) заряженные ионы. Подумайте о девушке Ане, сражающейся с вражеским шпионом.
Катионы
Это (+) заряженные ионы. Подумайте о катящейся шаровой молнии.
Экзотермические реакции
Это хим. реакции, при которых будет выделение теплоты. Подумайте о жарких экзотических странах.
Эндотермические реакции
Это хим. реакции, происходящие с поглощением теплоты из окружающей среды. Подумайте о том, как теплота внедряется.
Аллотропия
Аллотропия — это существование химических элементов в виде двух или более простых веществ или форм. Например, у углерода есть несколько абсолютно разных аллотропных форм, включая графит и алмаз. Подумайте о том, как в лесу по тропинкам бродят разные животные. Это хороший пример того, как можно создать индивидуальные ассоциации, столкнувшись с термином или фразой, которые не имеют ничего общего со своим значением или определением.
Аммиак
Аммиак — бесцветный газ с резким удушливым запахом — получают под давлением из водорода и азота в пропорции 3:1. Используя систему ДОМИНИК, представьте, как Кролик и Алиса (КА=31) сжимают два газа вместе. Затем газ преобразуют с помощью процесса Габера и используют в производстве азотной кислоты и удобрений, аммониевых солей, синильной кислоты, взрывчатки, чистящих средств и пластика. Чтобы запомнить это все, представьте себе, что в вашем гардеробе хранятся нижеперечисленные вещи. Боеприпасы напомнят о взрывах и фейерверках, хлорка и сода – о необходимости произвести уборку, а удобрения – о комнатных цветах.
Видите как легко создать нелепые образы, которые останутся в памяти до экзамена. Вам не придется прерываться во время ответа, лихорадочно вспоминая определение: информацию легко будете пересказывать и быстро отвечать на вопросы.
PĀRTA

Сайт:; https://vk.comСтоимость: пробный урок — бесплатно, от 2990 р./мес.
- Выпустили 6 стобалльников и 34+ ученика на 90+ баллов в 2020 году (только по химии)
- Бесплатный вебинар каждое воскресенье (тестовая часть и задания повышенной сложности)
- Сотрудничают с экспертом по подготовке к ЕГЭ
- Объясняют сложное простым языком
Подготовка к экзамену по химии проводится в формате мастер-группы. Преподаватель и куратор сами сдали ЕГЭ на высший балл и готовы помочь своим ученикам добиться топовых результатов.
В программе обучения (на тарифе Лайт):
- 16 занятий в месяц по 1,5-2 часа
- Домашняя работа с проверкой и разбором ошибок
- Личный ментор
- Беседа с другими учениками
- Входной тест
- Скрипты и конспекты к урокам
- Авторские документы от преподавателей
Доступно 3 тарифа на выбор:
- ЛАЙТ (описание выше)
- МЕДИУМ: тариф Лайт + Вебинар с экспертом ЕГЭ, курс экстра-повторение, зачёт и пробник
- ХАРД: тариф Медиум + Банк заданий, секретный канал с твоим преподавателем в Telegram, система жизней
sp3-Гибридизация
В sp3-гибридизацию вступают одна s-орбиталь и три p-орбитали. При этом образуются четыре sp3-гибридные орбитали:


Изображение с портала orgchem.ru
| Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным. |
Поэтому четыре гибридные орбитали углерода в состоянии sp3-гибридизации направлены в пространстве под углом 109о 28’ друг к другу, что соответствует тетраэдрическому строению.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109о 28’ |
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
| Например, пространственное строение н-бутана |
Советы для подготовки к ЕГЭ по химии
Составьте план
Например, каждую неделю в понедельник и среду два часа вы занимаетесь химией. Кроме того, вы можете воспользоваться нашим планером для подготовки. Записывайте в нём главные задачи дня и вопросы учителю, а также что нового вы узнали, какие темы прошли и какие ещё предстоит разобрать, что нужно поискать дополнительно.
Выберите наставника
Найдите человека, который сможет ответить на все возникающие вопросы. Это может быть учитель или знакомый студент, изучающий химию.
Определите ресурсы для подготовки к ЕГЭ
Это и печатные материалы, и электронные образовательные ресурсы. Помните, что ЕГЭ периодически меняют, и не все пособия могут быть актуальными, даже если выпущены в текущем году. Среди популярных ресурсов для подготовки к экзамену по химии:
- Д.Ю. Добротин, «Методические рекомендации обучающимся по организации индивидуальной подготовки к ЕГЭ. Химия», ФИПИ, Москва, 2020 г;
- В.Н. Доронькин и др. «ЕГЭ. Химия. Тематический тренинг. Задания базового и повышенного уровня сложности» Легион, Ростов-на Дону, 202_г.;
- В.Н. Доронькин и др. «ЕГЭ. Химия. Тематический тренинг. Задания высокого уровня сложности» Легион, Ростов-на Дону, 202_г.;
- Д.Ю. Добротина «ЕГЭ. Химия. Типовые экзаменационные варианты», Национальное образование, М, 202_г.;
- Е.В. Зыкова «Сборник задач и упражнений по органической химии» Феникс, Ростов-на Дону, 2019г.;
- Сайт ФИПИ;
- Образовательный портал «РЕШУ ЕГЭ»;
- Сайт «Наука для тебя».
Изучите спецификацию КИМ по предмету
Актуальная информация есть на сайте ФИПИ. Изучайте сначала теорию по каждому вопросу. Помните, что информации из школьного учебника может быть недостаточно. Выполняйте тематические тесты и только потом общие варианты ЕГЭ.
Внимательно читайте задания тестовой части
Не трактуйте тексты задач, основываясь на личных ассоциациях или опыте решения аналогичных заданий. Отвечайте на поставленный вопрос. Например, если вас просят записать ответ с точностью до десятых, не нужно записывать получившееся число полностью. Если просят выписать числа, соответствующие кислоте и щелочи, пишите только в той последовательности, которая соответствует кислоте и щелочи, а не наоборот
Особое внимание нужно обращать и на количество требуемых ответов к заданиям. С 2021 года в заданиях 19 и 20 предлагается выбрать все верные ответы
Их может быть два, три или четыре.
Изучите критерии оценивания заданий части 2
За правильно решенное, но неправильно оформленное задание вы можете потерять баллы. При этом некоторые нюансы знают только эксперты ЕГЭ
Например, необходимо обратить внимание, что если в задании №30 (ОВР) допустимо использовать удвоенные коэффициенты в уравнениях реакций, то в сокращенном ионном уравнении (задание №31) удвоенные коэффициенты недопустимы. Или, если ранее в задании №30 была допустима форма записи:
2Cl+2e=2Cl— 1 восстановление, окислитель;
то сейчас:
2Cl+2e=2Cl— 1 окислитель, восстановление;
т.е. окислитель и восстановитель (можно даже проставить просто буквы О или В) пишутся только спереди (допустимы и другие формы записи).
Если в задании №30 для некоторых химических элементов допустимо поставить и степень окисления, и заряд (S-2 и S2-), то для других элементов этого делать категорически нельзя (N+3, но не N3+, т.к. такой частицы реально не существует).
В задании №33 необходимо обратить внимание, как функциональные заместители или катализаторы влияют на направление химической реакции. Сравните, например, галогенирование алканов на свету и в жестких условиях; гидрогалогенирование несимметричных алкенов при нормальных условиях и в присутствии катализатора H2O2
Не читайте узкоспециализированную литературу
Во-первых, это отнимает время. Во-вторых, помните, что ЕГЭ проверяет школьные знания — они не всегда соответствуют современной науке.
Научитесь работать с непрограммируемым калькулятором
Помните: когда вы считаете в телефоне, он правильно проводит порядок действий. При работе с калькулятором порядок действий вам придется соблюдать самостоятельно. Посчитайте ради интереса в телефоне и на калькуляторе простейший пример: 2+2*2. Сравните ответы.
Проверяйте свои знания
Периодически проверяйте уровень усвоения как новых, так и ранее полученных знаний. Тематические тесты или полные варианты ЕГЭ вы можете найти на сайте ФИПИ. Подготовка к ЕГЭ 2021 по химии будет проще, если под рукой будут все необходимые материалы. Зарегистрируйтесь на нашем сайте и получите доступ к библиотеке полезных материалов для подготовки.
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
Алмаз — атомы углерода находятся в вершинах воображаемых тетраэдров;
Графит — атомы углерода находятся в одной плоскости;

Карбин — атомы углерода образуют «нити».
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
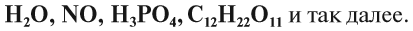
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:

В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).

Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
При этом следует учитывать изложенное выше правило о химической связи.

Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
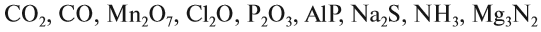
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
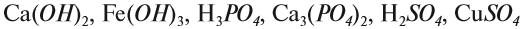
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях. Зная валентности атома или группы атомов можно составить формулу соединения
Для этого пользуются правилами:
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Если валентности одинаковы, то и число атомов одинаково, т. е. индексы не ставим:
Если валентности кратны (одно число делится на другое), то число атомов элемента с меньшей валентностью определяем делением:
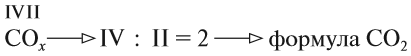
В остальных случаях индексы определяют «крест-накрест»:
Задание 1.4. Составьте химические формулы соединений:
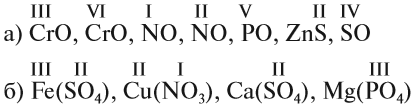

Теория к заданию 32 из ЕГЭ по химии
Взаимосвязь различных классов неорганических веществ
Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Единство и многообразие химических веществ этого мира наиболее ярко проявляется в генетической связи веществ, которая отражается в так называемых генетических рядах. Выделим наиболее характерные признаки таких рядов:
1. Все вещества этого ряда должны быть образованы одним химическим элементом. Например, ряд, записанный с помощью следующих формул:
$Br_2 → HBr → NaBr → NaNO_3$,
нельзя считать генетическим, т.к. в последнем звене элемент бром отсутствует, хотя реакция для перехода от $NaBr$ к $NaNO_3$ легко осуществима:
$NaBr + AgNO_3 = AgBr↓+ NaNO_3$.
Этот ряд мог бы считаться генетическим рядом элемента брома, если бы его завершили, например, так:
$Br_2 → HBr → NaBr → AgBr$.
2. Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам, т.е. отражать разные формы его существования.
3. Вещества, образующие генетический ряд одного элемента, должны быть связаны взаимопревращениями. По этому признаку можно различать полные и неполные генетические ряды.
Например, приведенный выше генетический ряд брома будет неполным, незавершенным. А вот следующий ряд:
$Br_2 → HBr → NaBr → AgBr → Br_2$
уже можно рассматривать как полный: он начинался простым веществом — бромом и им же закончился. Обобщая сказанное выше, можно дать следующее определение генетического ряда.
Генетическим называется ряд веществ — представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ или их генезис.
Генетическая связь — понятие более общее, чем генетический ряд, который является пусть и ярким, но частным проявлением этой связи, реализующейся при любых взаимных превращениях веществ. Тогда, очевидно, под это определение подходит и первый приведенный в тексте ряд веществ.
Для характеристики генетической связи неорганических веществ мы рассмотрим три разновидности генетических рядов.
Генетический ряд металла.
Наиболее богат ряд металла, у которого проявляются разные степени окисления. В качестве примера рассмотрим генетический ряд железа со степенями окисления $+2$ и $+3$:
${Fe}{\text»металл»}→{FeCl_2}{\text»соль — хлорид железа(II)»}→{Fe(OH)_2}{\text»основание — гидроксид железа(II)»}→{FeO}{\text»основный оксид — оксид железа(II)»}→{Fe}{\text»металл»}→{FeCl_3}{\text»соль — хлорид железа(III)»}→{Fe(OH)_3}{\text»гидроксид железа (III) — амфотерное соединение с преобладанием основных свойств»}→{Fe_2O_3}{\text»оксид железа(III), аналогичен по свойствам соответствующему гидроксиду»}→{Fe}{\text»металл»}$
Напомним, что для окисления железа в хлорид железа (II) нужно взять более слабый окислитель, чем для получения хлорида железа (III):
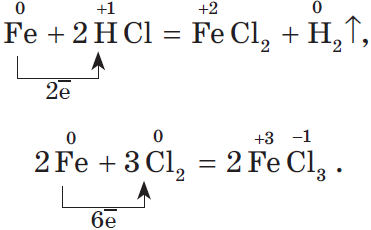
Генетический ряд неметалла.
Аналогично ряду металла более богат связями ряд неметалла с разными степенями окисления, например, генетический ряд серы со степенями окисления $+4$ и $+6$:
${S}{\text»неметалл»}$→${SO_2}{\text»кислотный оксид — оксид серы (IV)»}→{H_SO_3}{\text»сернистая кислота»}→{Na_SO_3}{\text»соль — сульфит натрия»}→{SO_2}{\text»кислотный оксид — оксид серы (IV)»}→{SO_3}{\text»кислотный оксид — оксид серы (VI)»}→{H_SO_4}{\text»серная кислота»}→{SO_2}{\text»кислотный оксид — оксид серы (IV)»}→{S}{\text»неметалл»}$
Затруднение может вызвать лишь последний переход. Руководствуйтесь правилом: чтобы получить простое вещество из окисленного соединения элемента, нужно взять для этой цели самое восстановленное его соединение, например, летучее водородное соединение неметалла. В нашем случае:
${SO_2}{+4}+2H_2{S}{-2}=2H_2O+S{0}↓.$
По этой реакции в природе из вулканических газов образуется сера.
Аналогично для хлора:
Генетический ряд металла, которому соответствуют амфотерные оксид и гидроксид, очень богат связями, т.к. они проявляют в зависимости от условий то кислотные, то основные свойства.
Например, рассмотрим генетический ряд цинка: