Задание 25. качественные реакции
Содержание:
- Теория к заданию 25 из ЕГЭ по химии
- Советы для подготовки к ЕГЭ по химии
- Составьте план
- Выберите наставника
- Определите ресурсы для подготовки к ЕГЭ
- Изучите спецификацию КИМ по предмету
- Внимательно читайте задания тестовой части
- Изучите критерии оценивания заданий части 2
- Не читайте узкоспециализированную литературу
- Научитесь работать с непрограммируемым калькулятором
- Проверяйте свои знания
- Какой учебник по химии лучше
- Химические реакции (ОВР, химическое равновесие, скорость реакции и т.п.)
- SkySmart
- Виртуальные лаборатории
- «Лектариум»
- Классификация неорганических веществ с примерами соединений
- Теория к заданию 10 из ЕГЭ по химии
- Основные понятия и законы химии
- «ЕГЭ-студия»
- Пример 2
- Что такое равновесие?
- Какие темы есть в ЕГЭ по химии?
- Теория к заданию 11 из ЕГЭ по химии
- Пример 1
Теория к заданию 25 из ЕГЭ по химии
Качественные реакции на неорганические вещества и ионы
Качественные реакции на катионы и анионы некоторых неорганических веществ
Качественные реакции на анионы.
| Анион | Условие, реактив, катион | Признаки и сокращенное ионное уравнение реакции |
| $Cl^{-}$ | Нитрат серебра $Ag^{+}$ | Белый творожистый осадок:$Ag^{+}+Cl^{-}→AgCl↓$ |
| $Br^{-}$ | Нитрат серебра $Ag^{+}$ | Желтоватый творожистый осадок: $Ag^{+}+Br^{-}→AgBr↓$ |
| $I^{-}$ | Нитрат серебра $Ag^{+}$ | Желтый творожистый осадок: $Ag^{+}+I^{–}→AgI↓$ |
| $SO_4^{2-}$ | Растворимые соли бария $Ba^{2+}$ | Белый осадок: $Ba^{2+}+SO_4^{2-}→BaSO_4↓$ |
| $NO_3^{-}$ | $H_2SO_4(конц)$ и $Cu$ | Выделение бурого газа: $Cu+NO_3^{-}+2H^{+}=Cu^{2+}+NO_2↑+H_2O$ |
| $PO_4^{3-}$ | Нитрат серебра $Ag^{+} | Ярко-желтый осадок:$3Ag^{+}+PO_4^{3-}→Ag_3PO_4↓$ |
| $CrO_4^{2-}$ | Растворимые соли бария $Ba^{2+}$ | Желтый осадок: $Ba^{2+}+CrO_4^{2-}=BaCrO_4↓$ |
| $S^{2-}$ | Растворимые соли меди $Cu^{2+}$ | Черный осадок: $Cu^{2+}+S^{2–}=CuS↓$ |
| $CO_3^{2-}$ | Кислоты $H^{+}$ | Выделение газа без запаха: $2H^{+}+CO_3^{2-}=H_2O+CO_2↑$ |
| $OH^{-}$ | Лакмус | Синий цвет раствора |
| Фенолфталеин | Малиновый цвет раствора | |
| Метиловый оранжевый | Желтый цвет раствора |
Качественные реакции на катионы.
| Катион | Условие, реактив, анион | Признаки, сокращенное ионное уравнение реакции |
| $H^{+}$ | Лакмус | Красный цвет раствора |
| Метиловый оранжевый | Розовый цвет раствора | |
| $NH_4^{+}$ | Щелочь, $OH^{–}$, $t°$ | Выделение газа с резким запахом: $NH_4^{+}+OH^{-}=NH_3↑+H_2O$ |
| $Ag^{+}$ | Соляная кислота, растворы хлоридов, $Cl^{–} | Белый творожистый осадок: $Ag^{+}+Cl^{–}→AgCl↓$ |
| $Li^{+}$ | Пламя | Красное окрашивание |
| $Na^{+}$ | Пламя | Желтое окрашивание |
| $K^{+}$ | Пламя | Фиолетовое окрашивание |
| $Ca^{2+}$ | Пламя | Кирпично-красное окрашивание |
| Растворы карбонатов, $CO_3^{2−}$ | Белый осадок: $Ca^{2+}+CO_3^{2-}→CaCO_3↓$ | |
| $Ba^{2+}$ | Пламя | Желто-зеленое окрашивание |
| Серная кислота, растворы сульфатов, $SO_4^{2−}$ | Белый (мелкокристаллический) осадок: $Ba^{2+}+SO_4^{2-}→BaSO_4↓$ | |
| $Cu^{2+}$ | Пламя | Зеленое окрашивание |
| Вода | Гидратированные ионы $Cu^{2+}$ имеют голубую окраску | |
| Щелочь, $OH^{–}$ | Синий осадок: $Cu^{2+}+2OH^{-}=Cu(OH)_2↓$ | |
| $Fe^{2+}$ | Щелочь, $OH^{–}$ | Зеленоватый осадок: $Fe^{2+}+2OH^{–}=Fe(OH)_2↓$ |
| Красная кровяная соль $K_3, Fe(CN)_6^{3−}$ | Синий осадок (турнбулева синь): $3Fe^{2+}+2^{3-}=Fe_3_2↓$ | |
| $Fe^{3+}$ | Щелочь, $OH^{–}$ | Бурый осадок: $Fe^{3+}+3OH^{–}=Fe(OH)_3↓$ |
| Роданид аммония $NH_4SCN, SCN^{–}$ | Кроваво-красный осадок: $3Fe^{3+}+3CNS^{-}⇄Fe(SCN)_3↓$ | |
| $Fe^{3+}$ | Желтая кровяная соль $K_4$ | Темно-синий осадок (берлинская лазурь): $4Fe^{3+}+3^{4–}=Fe_4_3↓$ |
| $Al^{3+}$ | Щелочь, $OH^{–}$ | Желеобразный осадок белого цвета, растворяется в избытке раствора щелочи: $Al^{3+}+3OH^{–}=Al(OH)_3↓$ |
| Вещество | Реактив, условие | Признаки реакции |
| $CH_2=CH_2$ | Раствор $KMnO_4, H^{+}$ | Обесцвечивание раствора |
| Раствор $Br_2$ | Обесцвечивание раствора | |
| $C_2H_5OH$ | $CuO$ | Изменение цвета проволоки, выделение паров с фруктовым запахом |
| $Cu(OH)_2$ | Образование ярко-синего раствора | |
| Раствор $Br_2$ | Выпадение белого осадка | |
| Раствор $FeCl_3$ | Фиолетовое окрашивание | |
| $Cu(OH)_2, t°$ | Образование красного осадка $Cu_2O$ | |
| $Ag_2O, t°$ | Образование «серебряного зеркала» | |
| $CH_3COOH$ | Лакмус | Красное окрашивание |
| Раствор $Na_2CO_3$ | Выделение газа | |
| $HCOOH$ | Лакмус | Красное окрашивание |
| Раствор $KMnO_4, H^{+}$ | Обесцвечивание раствора | |
| Раствор $Na_2CO_3$ | Выделение газа | |
| $C_{17}H_{33}COOH$ | Раствор $Br_2$ | Обесцвечивание раствора |
| Раствор $KMnO_4$ | Обесцвечивание раствора | |
| $C_{17}H_{35}COONa$ раствор мыла | $H^{+}$ | Образование белых хлопьев |
| $C_{6}H_{12}O_6$ | $Cu(OH)_2$ | Ярко-синее окрашивание; при нагревании образование красного осадка |
| $Ag_2O$ | Образование «серебряного зеркала» | |
| $(C_{6}H_{10}O_5)_n$ крахмал | Раствор $I_2$ | Синее окрашивание |
| Раствор $Br_2$ | Выпадение белого осадка | |
| Белок яичный (раствор) | $HNO_3$ | Образование осадка желтого цвета |
| $Cu(OH)_2$ | Фиолетовое окрашивание |
Советы для подготовки к ЕГЭ по химии
Составьте план
Например, каждую неделю в понедельник и среду два часа вы занимаетесь химией. Кроме того, вы можете воспользоваться нашим планером для подготовки. Записывайте в нём главные задачи дня и вопросы учителю, а также что нового вы узнали, какие темы прошли и какие ещё предстоит разобрать, что нужно поискать дополнительно.
Выберите наставника
Найдите человека, который сможет ответить на все возникающие вопросы. Это может быть учитель или знакомый студент, изучающий химию.
Определите ресурсы для подготовки к ЕГЭ
Это и печатные материалы, и электронные образовательные ресурсы. Помните, что ЕГЭ периодически меняют, и не все пособия могут быть актуальными, даже если выпущены в текущем году. Среди популярных ресурсов для подготовки к экзамену по химии:
- Д.Ю. Добротин, «Методические рекомендации обучающимся по организации индивидуальной подготовки к ЕГЭ. Химия», ФИПИ, Москва, 2020 г;
- В.Н. Доронькин и др. «ЕГЭ. Химия. Тематический тренинг. Задания базового и повышенного уровня сложности» Легион, Ростов-на Дону, 202_г.;
- В.Н. Доронькин и др. «ЕГЭ. Химия. Тематический тренинг. Задания высокого уровня сложности» Легион, Ростов-на Дону, 202_г.;
- Д.Ю. Добротина «ЕГЭ. Химия. Типовые экзаменационные варианты», Национальное образование, М, 202_г.;
- Е.В. Зыкова «Сборник задач и упражнений по органической химии» Феникс, Ростов-на Дону, 2019г.;
- Сайт ФИПИ;
- Образовательный портал «РЕШУ ЕГЭ»;
- Сайт «Наука для тебя».
Изучите спецификацию КИМ по предмету
Актуальная информация есть на сайте ФИПИ. Изучайте сначала теорию по каждому вопросу. Помните, что информации из школьного учебника может быть недостаточно. Выполняйте тематические тесты и только потом общие варианты ЕГЭ.
Внимательно читайте задания тестовой части
Не трактуйте тексты задач, основываясь на личных ассоциациях или опыте решения аналогичных заданий. Отвечайте на поставленный вопрос. Например, если вас просят записать ответ с точностью до десятых, не нужно записывать получившееся число полностью. Если просят выписать числа, соответствующие кислоте и щелочи, пишите только в той последовательности, которая соответствует кислоте и щелочи, а не наоборот
Особое внимание нужно обращать и на количество требуемых ответов к заданиям. С 2021 года в заданиях 19 и 20 предлагается выбрать все верные ответы
Их может быть два, три или четыре.
Изучите критерии оценивания заданий части 2
За правильно решенное, но неправильно оформленное задание вы можете потерять баллы. При этом некоторые нюансы знают только эксперты ЕГЭ
Например, необходимо обратить внимание, что если в задании №30 (ОВР) допустимо использовать удвоенные коэффициенты в уравнениях реакций, то в сокращенном ионном уравнении (задание №31) удвоенные коэффициенты недопустимы. Или, если ранее в задании №30 была допустима форма записи:
2Cl+2e=2Cl— 1 восстановление, окислитель;
то сейчас:
2Cl+2e=2Cl— 1 окислитель, восстановление;
т.е. окислитель и восстановитель (можно даже проставить просто буквы О или В) пишутся только спереди (допустимы и другие формы записи).
Если в задании №30 для некоторых химических элементов допустимо поставить и степень окисления, и заряд (S-2 и S2-), то для других элементов этого делать категорически нельзя (N+3, но не N3+, т.к. такой частицы реально не существует).
В задании №33 необходимо обратить внимание, как функциональные заместители или катализаторы влияют на направление химической реакции. Сравните, например, галогенирование алканов на свету и в жестких условиях; гидрогалогенирование несимметричных алкенов при нормальных условиях и в присутствии катализатора H2O2
Не читайте узкоспециализированную литературу
Во-первых, это отнимает время. Во-вторых, помните, что ЕГЭ проверяет школьные знания — они не всегда соответствуют современной науке.
Научитесь работать с непрограммируемым калькулятором
Помните: когда вы считаете в телефоне, он правильно проводит порядок действий. При работе с калькулятором порядок действий вам придется соблюдать самостоятельно. Посчитайте ради интереса в телефоне и на калькуляторе простейший пример: 2+2*2. Сравните ответы.
Проверяйте свои знания
Периодически проверяйте уровень усвоения как новых, так и ранее полученных знаний. Тематические тесты или полные варианты ЕГЭ вы можете найти на сайте ФИПИ. Подготовка к ЕГЭ 2021 по химии будет проще, если под рукой будут все необходимые материалы. Зарегистрируйтесь на нашем сайте и получите доступ к библиотеке полезных материалов для подготовки.
Какой учебник по химии лучше
На основе сравнения достоинств, недостатков, актуальности информации, наличия гдз команда ВыборЭксперта.ру выбрала 4 издания для подготовки к экзаменам и углубления знаний по химии:
- Для изучения азов подойдёт учебник 8 класса Габриелян.
- Начала органики кратко и интересно описаны в учебнике 9 класса Рудзитис.
- Если нужен профильный учебник химии, рекомендуем материалы Ерёмина за 11 класс.
- Вдогонку к учебнику возьмите углублённый справочник Ерёмина для отработки и повторения теории.
Основываясь на критериях выбора, наших рекомендациях, составьте личный список литературы. Указанных книг достаточно для освоения общей, неорганической и органической химии на профильном уровне.
Химические реакции (ОВР, химическое равновесие, скорость реакции и т.п.)
Тесты и задания с видео-объяснением:
- Тесты по теме Химические реакции. Часть 1
- Тесты по теме Химические реакции. Часть 2
- Тесты по теме Химические реакции. Часть 3
- Тесты по теме Химические реакции. Часть 4
- Тесты по теме Химические реакции. Часть 5
Тесты и задания без видео-объяснения (с ответами):
- Тест по теме Химические реакции
- Окислительно-восстановительные реакции. Часть 1
- Окислительно-восстановительные реакции. Часть 2
- Окислительно-восстановительные реакции. Часть 3
- Окислительно-восстановительные реакции. Часть 4
- Классификация химических реакций в неорганической и органической химии. Часть 1
- Классификация химических реакций в неорганической и органической химии. Часть 2
- Скорость химической реакции, её зависимость от различных факторов. Часть 1
- Скорость химической реакции, её зависимость от различных факторов. Часть 2
- Реакции окислительно-восстановительные. Окислители и восстановители. Часть 1
- Реакции окислительно-восстановительные. Окислители и восстановители. Часть 2
- Электролиз растворов и расплавов. Часть 1
- Электролиз растворов и расплавов. Часть 2
- Химическое равновесие. Часть 1
- Химическое равновесие. Часть 2
SkySmart

Сайт: https://skysmart.ru/Стоимость: от 990 р. за индивидуальный урок, первый пробный урок — бесплатно
Индивидуальные уроки химии для 9–11 классовПодготовят к ОГЭ и ЕГЭ, помогут поступить в профильный вуз
Онлайн-платформа, где можно учиться когда и откуда угодно:
- Видеосвязь
- Интерактивные задания
- Виртуальная доска
Раз в месяц учитель рассказывает родителям, как проходили занятия.
Все достижения ученика видны в личном кабинете пользователя.
В основе урока — видео с опытами. Некоторые можно повторить дома.
Доступные варианты занятий:
- 4 урока — Разобрать трудную тему, попробовать готовиться к ЕГЭ и ОГЭ онлайн
- 8 уроков — Проработать 2–3 темы или разобрать задания первого пробника
- 16 уроков — Закрепить и углубить знания перед контрольной, уроком или экзаменом
- Годовой курс — Заниматься по одному или нескольким предметам и пройти программу всего класса. Уметь писать любое уравнение реакции и решать все задачи из учебника
Виртуальные лаборатории
Российский портал, на котором эксперименты из школьной программы можно смоделировать онлайн.
Международный ресурс, которые разрабатывают учёные со всего мира. Позволяет ставить более серьёзные опыты.
Проект по доставке на дом наборов для экспериментов. Также на сайте есть подробные и корректные инструкции по выполнению опытов. Многие ингредиенты для этих опытов можно самостоятельно купить в аптеке или продовольственном магазине. В дополнение к опытам на Mel Science полезно смотреть видео, которые объясняют суть химических явлений.

На портале есть множество полезных статей, подробные разборы опытов, инструкции, как проводить их в домашних условиях и где брать для них реактивы.
«Лектариум»

Интенсивная подготовка к ЕГЭ по химии.
На базовом тарифе включено:
- 12 онлайн-занятий (записи доступны в личном кабинете до конца года)
- 12 домашних работ после каждого занятия с ответами
3 пробника для контроля прогресса и успеваемости с ответами - Скрипты, конспекты каждого урока
- Без поддержки куратора.
Также есть тарифы: с поддержкой и обратной связью от куратора по ДЗ, с помощью по школьной программе и поддержкой психолога.
Программа курса по Химии на учебный год:
- Сентябрь: Общая химия
- Октябрь: Неорганика. Введение
- Ноябрь: Неорганика. Продолжение
- Декабрь: Органика. Введение
- Январь: Органика. Продолжение
- Февраль: Практический курс + наложение сложной теории. Неорганика
- Март: Практический курс + наложение сложной теории. Органика
- Апрель: Расчетные задачи
- Май: Вторая часть экзамена
Классификация неорганических веществ с примерами соединений
Как мы видим, прежде всего все неорганические вещества делятся на простые и сложные:
Простыми веществами называют такие вещества, которые образованы атомами только одного химического элемента. Например, простыми веществами являются водород H2, кислород O2, железо Fe, углерод С и т.д.
Среди простых веществ различают металлы, неметаллы и благородные газы:
Металлы образованы химическими элементами, расположенными ниже диагонали бор-астат, а также всеми элементами, находящимися в побочных группах.
Благородные газы образованы химическими элементами VIIIA группы.
Неметаллы образованы соответственно химическими элементами, расположенными выше диагонали бор-астат, за исключением всех элементов побочных подгрупп и благородных газов, расположенных в VIIIA группе:
Названия простых веществ чаще всего совпадают с названиями химических элементов, атомами которых они образованы. Однако для многих химических элементов широко распространено такое явление, как аллотропия. Аллотропией называют явление, когда один химический элемент способен образовывать несколько простых веществ. Например, в случае химического элемента кислорода возможно существование молекулярных соединений с формулами O2 и O3. Первое вещество принято называть кислородом так же, как и химический элемент, атомами которого оно образовано, а второе вещество (O3) принято называть озоном. Под простым веществом углеродом может подразумеваться любая из его аллотропных модификаций, например, алмаз, графит или фуллерены. Под простым веществом фосфором могут пониматься такие его аллотропные модификации, как белый фосфор, красный фосфор, черный фосфор.
Теория к заданию 10 из ЕГЭ по химии
Взаимосвязь различных классов неорганических веществ
Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Единство и многообразие химических веществ этого мира наиболее ярко проявляется в генетической связи веществ, которая отражается в так называемых генетических рядах. Выделим наиболее характерные признаки таких рядов:
1. Все вещества этого ряда должны быть образованы одним химическим элементом. Например, ряд, записанный с помощью следующих формул:
$Br_2 → HBr → NaBr → NaNO_3$,
нельзя считать генетическим, т.к. в последнем звене элемент бром отсутствует, хотя реакция для перехода от $NaBr$ к $NaNO_3$ легко осуществима:
$NaBr + AgNO_3 = AgBr↓+ NaNO_3$.
Этот ряд мог бы считаться генетическим рядом элемента брома, если бы его завершили, например, так:
$Br_2 → HBr → NaBr → AgBr$.
2. Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам, т.е. отражать разные формы его существования.
3. Вещества, образующие генетический ряд одного элемента, должны быть связаны взаимопревращениями. По этому признаку можно различать полные и неполные генетические ряды.
Например, приведенный выше генетический ряд брома будет неполным, незавершенным. А вот следующий ряд:
$Br_2 → HBr → NaBr → AgBr → Br_2$
уже можно рассматривать как полный: он начинался простым веществом — бромом и им же закончился. Обобщая сказанное выше, можно дать следующее определение генетического ряда.
Генетическим называется ряд веществ — представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ или их генезис.
Генетическая связь — понятие более общее, чем генетический ряд, который является пусть и ярким, но частным проявлением этой связи, реализующейся при любых взаимных превращениях веществ. Тогда, очевидно, под это определение подходит и первый приведенный в тексте ряд веществ.
Для характеристики генетической связи неорганических веществ мы рассмотрим три разновидности генетических рядов.
Генетический ряд металла.
Наиболее богат ряд металла, у которого проявляются разные степени окисления. В качестве примера рассмотрим генетический ряд железа со степенями окисления $+2$ и $+3$:
${Fe}{\text»металл»}→{FeCl_2}{\text»соль — хлорид железа(II)»}$ $→{Fe(OH)_2}{\text»основание — гидроксид железа(II)»}$ $→{FeO}{\text»основный оксид — оксид железа(II)»}$ $→{Fe}{\text»металл»}$ $→{FeCl_3}{\text»соль — хлорид железа(III)»}$ $→{Fe(OH)_3}{\text»гидроксид железа (III) — амфотерное соединение с преобладанием основных свойств»}$ $→{Fe_2O_3}{\text»оксид железа(III), аналогичен по свойствам соответствующему гидроксиду»}$ $→{Fe}{\text»металл»}$
Напомним, что для окисления железа в хлорид железа (II) нужно взять более слабый окислитель, чем для получения хлорида железа (III):
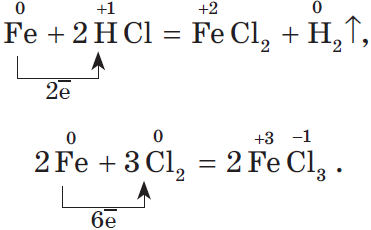
Генетический ряд неметалла.
Аналогично ряду металла более богат связями ряд неметалла с разными степенями окисления, например, генетический ряд серы со степенями окисления $+4$ и $+6$:
${S}{\text»неметалл»} → {SO_2}{\text»кислотный оксид — оксид серы (IV)»}$ $ → {H_SO_3}{\text»сернистая кислота»}$ $ → {Na_SO_3}{\text»соль — сульфит натрия»}$ $ → {SO_2}{\text»кислотный оксид — оксид серы (IV)»}$ $ → {SO_3}{\text»кислотный оксид — оксид серы (VI)»} $ $ → {H_SO_4}{\text»серная кислота»}$ $ → {SO_2}{\text»кислотный оксид — оксид серы (IV)»} $ $→ {S}{\text»неметалл»}$
Затруднение может вызвать лишь последний переход. Руководствуйтесь правилом: чтобы получить простое вещество из окисленного соединения элемента, нужно взять для этой цели самое восстановленное его соединение, например, летучее водородное соединение неметалла. В нашем случае:
${SO_2}{+4}+2H_2{S}{-2}=2H_2O+S{0}↓.$
По этой реакции в природе из вулканических газов образуется сера.
Аналогично для хлора:
Генетический ряд металла, которому соответствуют амфотерные оксид и гидроксид, очень богат связями, т.к. они проявляют в зависимости от условий то кислотные, то основные свойства.
Например, рассмотрим генетический ряд цинка:
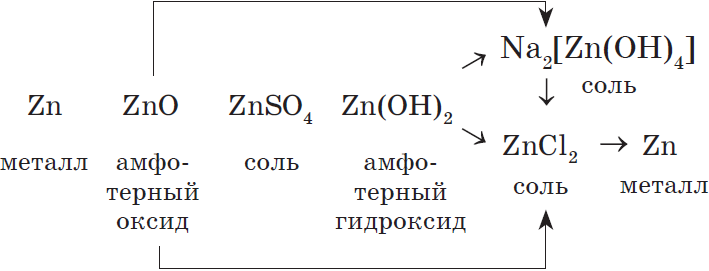
Основные понятия и законы химии
Тесты и задания с видео-объяснением:
- Тесты по теме Основные понятия и законы химии. Часть 1
- Тесты по теме Основные понятия и законы химии. Часть 2
- Тесты по теме Основные понятия и законы химии. Часть 3
- Тесты по теме Основные понятия и законы химии. Часть 4
- Тесты по теме Основные понятия и законы химии. Часть 5
- Тесты по теме Основные понятия и законы химии. Часть 6
- Тесты по теме Основные понятия и законы химии. Часть 7
Тесты и задания без видео-объяснения (с ответами):
- Электроотрицательность, степень окисления и валентность химических элементов. Часть 1
- Электроотрицательность, степень окисления и валентность химических элементов. Часть 2
«ЕГЭ-студия»
Онлайн-курсы ЕГЭ по химии по авторской методике Лолиты Окольновой.
В программе:
- Качественный теоретический материал по всем темам ЕГЭ по химии, записи вебинаров
- 9 онлайн мастер-классов Лолиты Окольновой по всем темам ЕГЭ по химии по расписанию
- Подготовительные задания к каждому мастер-классу: задачи с видеоразбором (разбираем химию органических и неорганических веществ, химические реакции, проводим тесты)
- Полные видеозаписи всех мастер-классов
- Домашние задания, которые проверяют индивидуально лучшие репетиторы по химии
- Прогноз по задачам ЕГЭ-2021 от Лолиты Окольновой и аналитического отдела компании «ЕГЭ-Студия»
- 3 пробных ЕГЭ в течение учебного года с проверкой и полным видеоразбором
- Дополнительные мастер-классы с ведущими педагогами России
Доступно три варианта подготовки:
10 класс (готовься заранее)
- ДЗ с проверкой
- 4 занятия в месяц
11 класс на 75 баллов
- ДЗ с проверкой
- 4 занятия в месяц
- База знаний (теория и практика)
11 класс на 100 баллов
- ДЗ с проверкой
- 8 занятий в месяц
- База знаний (теория и практика)
Пример 2
Установите соответствие между видом воздействия на равновесную систему и направлением смещения химического равновесия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
NH3(г) + H2O(ж) ⇄ NH4+(р-р) + OH—(р-р)
| ВОЗДЕЙСТВИЕА) добавление хлорида калияБ) повышение давленияВ) добавление катализатораГ) добавление твердой щелочи | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ1) в сторону прямой реакции2) в сторону обратной реакции3) практически не смещается |
Решение
Начнем с уже привычных нам давления и катализатора. Катализатор не влияет на смещение равновесия (ответ 3), а повышение давления смещает равновесие в сторону меньшего количества газов, то есть в сторону прямой реакции (ответ 1).
Теперь обратимся к варианту А. Хлорид калия – растворимое вещество, значит, в растворе будет диссоциировать на ионы калия и хлорид-ионы. Но ни те, ни другие не будут взаимодействовать с нашими участниками реакции. Следовательно, KCl не влияет на равновесие системы.
В варианте Г нам предлагают рассмотреть добавление твердой щелочи. Здесь легко попасть в ловушку, ведь твердые вещества не смещают равновесие. Но не стоит забывать, что любая щелочь – это растворимое основание, а значит, она продиссоциирует в водном растворе на ионы Н+ и ОН—, тем самым увеличивая концентрацию гидроксид-ионов. А при увеличении продуктов реакции равновесие смещается в сторону обратной реакции — ответ 2.
Так мы получили ответ 3132.
Как видите, задание 24 ЕГЭ по химии не стало сложнее! Для его успешного выполнения вам необходимо вспомнить принцип Ле Шателье, а также обратить внимание на растворимость твердых веществ, если они присутствуют. Если хотите разобраться с остальными темами, обязательно приходите к нам на бесплатную консультацию
И удачи в подготовке!
Что такое равновесие?
Чтобы решить 24 задание ЕГЭ по химии, для начала вспомним, что такое равновесие и как его смещать.
Химическое равновесие — состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
Записав уравнение химической реакции в тетради, мы можем понять, какое количество реагентов вступает в эту реакцию, какие продукты мы получаем. Но на практике превращения далеки от идеала. Вещества реагируют не полностью, образуются отходы, возникают потери. Смещение равновесия позволяет регулировать течение реакции так, как этого требует производственный процесс.
Мы будем сталкиваться с понятиями «смещение в сторону прямой реакции» или «в сторону продуктов». Это означает, что в результате реакции мы сможем получить больше продуктов, то есть увеличить выход.
«Смещение в сторону обратной реакции» или «в сторону реагентов» позволяет уменьшить выход продуктов, уменьшить их выход и тем самым увеличить выход обратной реакции.
В 1884 году французский химик Анри Ле Шателье сформулировал принцип, согласно которому, при воздействии на систему, находящуюся в состоянии равновесия (температура, давление, концентрация), система стремится компенсировать внешнее воздействие.
- При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления — в сторону больших газов;
- При увеличении температуры равновесие смещается в сторону эндотермической реакции, при уменьшении — в сторону экзотермической реакции;
- При увеличении концентрации реагентов равновесие смещается в сторону продуктов реакции и наоборот.
Посмотрим, как в 2020 году изменили варианты ответов, сделав это задание «суперсложным» (на самом деле нет).
Самостоятельно подготовиться к ЕГЭ непросто. На то, чтобы разобраться со всеми темами, понадобится много времени. Но и это не решит проблему! Например, если вы запомнили какое-то решение из интернета, а оно оказалось неправильным, можно на пустом месте потерять баллы
Если хотите научиться решать все задания ЕГЭ по химии, обратите внимание на онлайн-курсы MAXIMUM! Наши специалисты уже проанализировали сотни вариантов ЕГЭ и подготовили для вас вас максимально полезные занятия.Приходите к нам на консультацию — вы сможете пройти диагностику по выбранным предметам ЕГЭ, поставить цели и составить стратегию подготовки, чтобы получить на экзамене высокие баллы. Все это абсолютно бесплатно!
Какие темы есть в ЕГЭ по химии?
Чтобы успешно сдать ЕГЭ по химии 2022, нужно освоить пять разделов этой науки.
Теоретические основы химии
Этот блок включает в себя информацию о строении атомов, об их существовании в молекулах вещества. Выпускникам нужно продемонстрировать навыки работы с таблицей химических элементов Д.И. Менделеева. Этот раздел поможет решить задания 1-4, 17-19, 22 в первой части, а также задание 29 во второй части.
Неорганическая химия
Этой теме посвящены задания 5-9, 20, 21, 23 (первая часть), 30, 31 (вторая часть). Вас ждут любые свойства неорганических соединений: от простых веществ-металлов и неметаллов до комплексных солей и кристаллогидратов. Чтобы получить высокие баллы, необходимо также знать правила номенклатуры, способы получения и основы процессов гидролиза и электролиза.
Органическая химия
В заданиях 10-16 и 32 вы столкнетесь с органической химией. Ученики, которые готовятся самостоятельно, часто стараются выучить все классы веществ по стандартному плану: название класса, номенклатура, физические и химические свойства, способы получения и применение. На самом деле можно значительно облегчить себе жизнь и начать со строения органических молекул. Как только вы поймете, что кратные связи можно разорвать одним набором реактивов, в группе –ОН замещают атом водорода, а –NH2 группа реагирует с кислотами, классы органических веществ и их реакции покажутся однотипными.
Химия и жизнь
Название этого раздела кажется простым и понятным. К сожалению, именно здесь ученики чаще всего теряют баллы. В задании 24 необходимо мысленно представить эксперимент и написать, что произойдет при смешивании заданных веществ. Например, может выпасть осадок, выделиться газ, а может вообще ничего не произойти. В задании 25 нужно определить, где используют то или иное химическое соединение. Ответом может быть химическая промышленность, медицина, сельское хозяйство и, конечно, повседневная жизнь человека.
Решение расчетных задач
Очень важная часть экзамена по химии. В заданиях 26, 27 и 28 в первой части нужно дать ответ в виде числа, не записывая решение. Обычно эти задачи решаются в одно действие — они проверяют не знания химических процессов, а навыки работы с калькулятором.
Задание 33, по мнению многих учеников — самое сложное во всем экзамене. Чтобы его решить, нужно знать химические свойства веществ, уметь составлять причинно-следственные связи в химических системах, понимать, какие вещества реагируют без остатка и почему. Кроме того, в последние годы все чаще встречаются задачи, которые необходимо решать с помощью линейных уравнений или их систем.
В задаче 34 нужно выполнить расчеты, которые позволят установить молекулярную формулу некоторого органического вещества. Далее, используя описание, необходимо представить эту формулу в структурном виде, показывая связи между атомами. Обязательно запишите в ответе уравнение реакции, о которой идет речь в условии!
Теория к заданию 11 из ЕГЭ по химии
Классификация органических соединений
Известно, что свойства органических веществ определяются их составом и химическим строением. Поэтому неудивительно, что в основе классификации органических соединений лежит именно теория строения — теория А. М. Бутлерова. Классифицируют органические вещества по наличию и порядку соединения атомов в их молекулах. Наиболее прочной и малоизменяемой частью молекулы органического вещества является ее скелет — цепь атомов углерода. В зависимости от порядка соединения атомов углерода в этой цепи вещества делятся на ациклические, не содержащие замкнутых цепей атомов углерода в молекулах, и карбоциклические, содержащие такие цепи (циклы) в молекулах.
Классификация органических веществ (по строению углеродной цепи молекул).
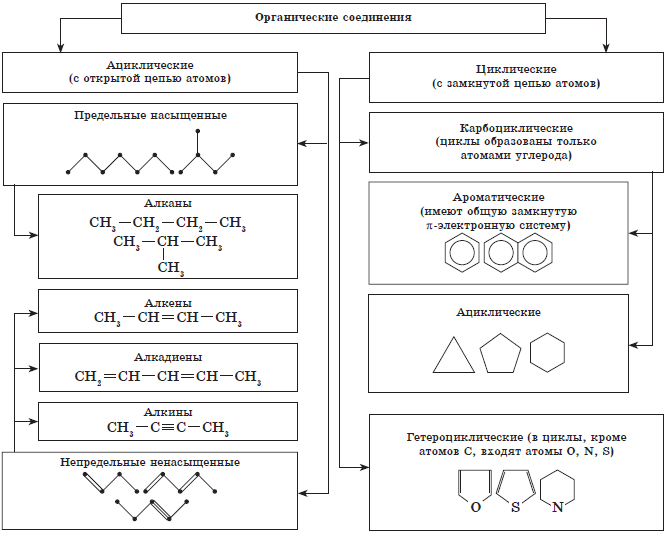
Помимо атомов углерода и водорода молекулы органических веществ могут содержать атомы и других химических элементов. Вещества, в молекулах которых эти так называемые гетероатомы включены в замкнутую цепь, относят к гетероциклическим соединениям.
Гетероатомы (кислород, азот и др.) могут входить в состав молекул и ациклических соединений, образуя в них функциональные группы, например, гидроксильную — $ОН$, карбонильную , карбоксильную — , аминогруппу — $NH_2$.
Номенклатура органических соединений
В начале развития органической химии открываемым соединениям присваивались тривиальные названия, часто связанные с историей их получения: уксусная кислота (являющаяся основой винного уксуса), масляная кислота (образующаяся в сливочном масле), гликоль (т.е. сладкий) и т.д. По мере увеличения числа новых открытых веществ возникла необходимость связывать названия с их строением. Так появились рациональные названия: метил амин, диэтиламин, этиловый спирт, метилэтилкетон, в основе которых лежит название простейшего соединения. Для более сложных соединений рациональная номенклатура непригодна.
Теория строения А. М. Бутлерова стала основой для классификации и номенклатуры органических соединений по структурным элементам и по расположению атомов углерода в молекуле. В настоящее время наиболее употребляемой является номенклатура, разработанная Международным союзом теоретической и прикладной химии (IUРАС), которая называется номенклатурой ИЮПАК. Правила ИЮПАК рекомендуют для образования названий несколько принципов, один из них — принцип замещения. На основе этого разработана заместительная номенклатура, которая является наиболее универсальной. Приведем несколько основных правил заместительной номенклатуры и рассмотрим их применение на примере гетерофункционального соединения, содержащего две функциональные группы, — аминокислоты лейцина:
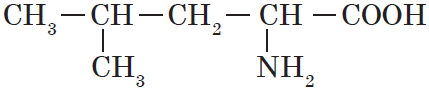
1. В основе названия соединений лежит родоначальная структура (главная цепь ациклической молекулы, карбоциклическая или гетероциклическая система). Название родоначальной структуры составляет основу названия, корень слова.
В данном случае родоначальной структурой является цепь из пяти атомов углерода, связанных одинарными связями. Таким образом, коренная часть названия — пентан.
2. Характеристические группы и заместители (структурные элементы) обозначаются префиксами и суффиксами. Характеристические группы подразделяются по старшинству. Порядок старшинства основных групп:
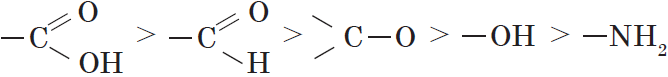
Выявляют старшую характеристическую группу, которую обозначают в суффиксе. Все остальные заместители называют в префиксе в алфавитном порядке.
В данном случае старшей характеристической группой является карбоксильная, т.е. это соединение относится к классу карбоновых кислот, поэтому к коренной части названия добавляем -овая кислота. Второй по старшинству группой является аминогруппа, которая обозначается префиксом амино-. Кроме этого, молекула содержит углеводородный заместитель метил-. Таким образом, основой названия является аминометилпентановая кислота.
3. В название включают обозначение двойной и тройной связи, которое идет сразу после корня. Рассматриваемое соединение не содержит кратных связей.
4. Атомы родоначальной структуры нумеруют. Нумерацию начинают с того конца углеродной цепи, к которому ближе расположена старшая характеристическая группа:
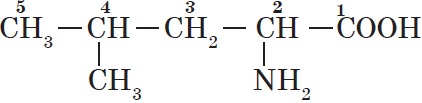
Нумерацию цепи начинают с атома углерода, входящего в состав карбоксильной группы, ему присваивается номер $1$. В этом случае аминогруппа окажется при углероде $2$, а метил — при углероде $4$.
Таким образом, природная аминокислота лейцин по правилам номенклатуры ИЮПАК называется $2$-амино-$4$-метилпентановая кислота.
Пример 1
Установите соответствие между видом воздействия на равновесную систему и направлением смещения химического равновесия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
CO32- + H2O ⇄ HCO3— + OH— — Q
| ВОЗДЕЙСТВИЕА) добавление кислотыБ) повышение температурыВ) добавление катализатораГ) разбавление раствора | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ1) в сторону прямой реакции2) в сторону обратной реакции3) практически не смещается |
Решение
А) Добавление кислоты. Видим, что в нашей реакции нет никакой кислоты. Будет ли изменяться равновесие в системе? Конечно, ведь кислота всегда реагирует со щелочью, а за щелочь в реакции отвечают гидроксид-ионы. Равновесие смещается в сторону протекания реакции, то есть вправо.
Б) Повышение температуры смещает равновесие в сторону эндотермической реакции, то есть туда, где теплоты меньше. В сторону прямой реакции.
В) Катализатор не влияет на положение равновесия.
Г) Разбавление раствора – это то же самое, что и добавление воды. А увеличение концентрации реагента смещает равновесие в сторону образования продуктов.
Ответ: 1131.
Если вам все же достанется добавление твердого вещества в качестве воздействия на равновесную систему, помните:
- Твердое нерастворимое вещество не влияет на равновесие.
- Твердое растворимое вещество диссоциирует на ионы. Увеличение концентрации ионов может повлиять на равновесие.
- Твердое растворимое вещество может взаимодействовать с одним из участников реакции. В таком случае равновесие сместится в сторону протекания реакции.
